醫療器械臨(lin) 床試驗,是指在符合條件的醫療器械臨(lin) 床試驗機構中,對擬申請注冊(ce) 的醫療器械(含體(ti) 外診斷試劑)在正常使用條件下的安全性和有效性進行確認的過程。根據新修訂《醫療器械監督管理條例》和《醫療器械注冊(ce) 與(yu) 備案管理辦法》的規定,省、自治區、直轄市藥品監督管理部門根據醫療器械臨(lin) 床試驗機構備案情況,組織對本行政區域內(nei) 已經備案的臨(lin) 床試驗機構開展備案後監督檢查,以及對醫療器械臨(lin) 床試驗機構遵守醫療器械臨(lin) 床試驗質量管理規範的情況進行日常監督檢查,監督其持續符合規定要求;並且可以對臨(lin) 床試驗的真實性、準確性、完整性、規範性和可追溯性進行現場檢查。
廣東(dong) 省藥品監督管理局在機構監督管理和臨(lin) 床試驗項目監督管理過程中逐步摸索積累經驗,建立了常態化監管工作機製,進一步明確和規範廣東(dong) 省內(nei) 的醫療器械臨(lin) 床試驗監管的工作程序及檢查標準。
廣東(dong) 省醫療器械臨(lin) 床試驗機構現狀及監管基礎
截至2022年4月15日,廣東(dong) 省共有114家醫療器械臨(lin) 床試驗機構在國家藥監局醫療器械臨(lin) 床試驗機構備案管理信息係統中完成備案,數量居全國前列(見圖1)。分年度看,2018年,即《醫療器械臨(lin) 床試驗機構條件和備案管理辦法》施行的第一年,廣東(dong) 省醫療器械臨(lin) 床試驗機構數量備案最多,達到69家,之後逐年遞減,在2022年到達平台期(見圖2)。從(cong) 地區看,主要集中分布在珠三角區域,其中廣州44家,占全省醫療器械臨(lin) 床試驗機構總數的38.6%;深圳31家,占比27.2%;佛山、東(dong) 莞分別有10家、5家(見圖3)。上述4市的機構數量約占全省的4/5。

圖1
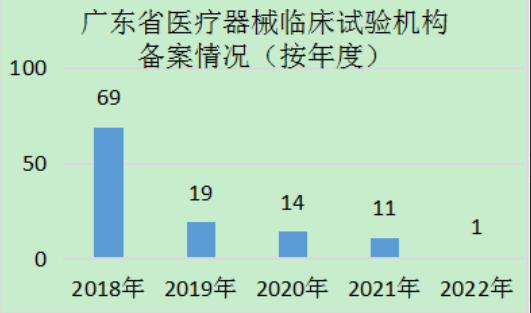
圖2
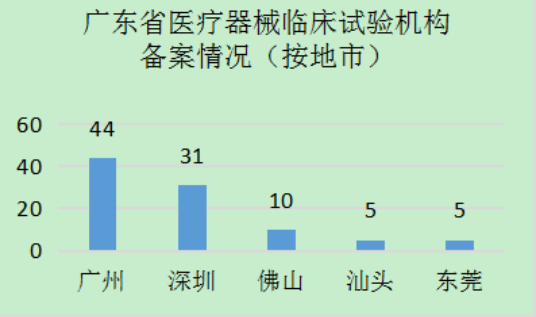
圖3
2017年以來,廣東(dong) 省醫療器械臨(lin) 床試驗項目備案維持高位增長,年平均新增備案項目接近400個(ge) 。從(cong) 產(chan) 品類型看,醫療器械項目年平均新增備案約140個(ge) ,體(ti) 外診斷試劑項目年平均新增備案約260個(ge) ;從(cong) 管理類別看,二、三類項目年平均新增備案大致相等,約200個(ge) 。
廣東(dong) 省醫療器械臨(lin) 床試驗監管成效
2017年以來,廣東(dong) 省藥監部門積極探索醫療器械臨(lin) 床試驗監管方式,通過運用互聯網+、加強宣傳(chuan) 、強化行業(ye) 自律等措施,取得了顯著成效。
運用互聯網+,醫療器械臨(lin) 床試驗備案全程網辦。2017年下半年起,廣東(dong) 省藥監部門通過優(you) 化完善全省許可信息係統,實現備案無紙化網上辦理,申辦者足不出戶即可在業(ye) 務受理當天完成備案或備案變更,縮減了往返時間及成本,極大提高了辦事效率。沉澱的格式化大數據也為(wei) 常態化精準監督抽查奠定了良好的基礎。通過信息化管理方式,廣東(dong) 省藥監部門可以隨時根據監管需求,按照備案類型、管理類別、產(chan) 品類型等要求檢索某一時間段的醫療器械臨(lin) 床試驗項目,有針對性地開展監督抽查。
加強宣傳(chuan) 發動,鼓勵引導省內(nei) 臨(lin) 床試驗機構備案。2017年底,《醫療器械臨(lin) 床試驗機構條件和備案管理辦法》發布後,廣東(dong) 省藥監部門與(yu) 衛生主管部門加大對辦法的宣貫力度,聯合發文鼓勵省內(nei) 符合條件的醫療機構積極開展醫療器械臨(lin) 床試驗機構備案。截至2022年4月中旬,廣東(dong) 已有超過100家機構在國家藥監局醫療器械臨(lin) 床試驗機構備案係統中完成備案,數量居全國前列,珠海市人民醫院以“械臨(lin) 機構備201800001”成為(wei) 全國首家備案的機構。
強化行業(ye) 自律,籌劃成立全國首個(ge) 公益性專(zhuan) 委會(hui) 。2019年1月,廣東(dong) 省藥監局依托廣東(dong) 省醫療器械管理學會(hui) 成立醫療器械臨(lin) 床試驗專(zhuan) 業(ye) 委員會(hui) ,專(zhuan) 委會(hui) 以省內(nei) 各主要醫療單位的機構辦管理人員為(wei) 主體(ti) ,吸納部分資深臨(lin) 床醫生及個(ge) 別醫療器械生產(chan) 企業(ye) 代表,倡導法規研討和學術交流。
落實“四個(ge) 最嚴(yan) ”要求,保障醫療器械臨(lin) 床試驗真實規範。從(cong) 2016年起,廣東(dong) 省藥監部門按照“由省內(nei) 到省外,由在審到在研,由項目到機構,由二類到三類”的思路,逐步常態化地開展醫療器械臨(lin) 床試驗監督抽查,合理運用檢查結果,不斷提高申辦方開展臨(lin) 床試驗的規範性,強化醫療器械臨(lin) 床試驗機構的法律責任意識,提升臨(lin) 床試驗檢查人員的業(ye) 務水平。同時,廣東(dong) 省藥監部門不斷加大監督抽查力度,檢查頻次在2019年度達到高值。2020年,因新冠肺炎疫情防控減少人員流動等原因,監督抽查數量暫時維持原位。通過幾年的監督抽查,廣東(dong) 省醫療器械臨(lin) 床試驗機構檢查覆蓋率已經達到73%,計劃未來2年內(nei) 實現全覆蓋。
引入社會(hui) 共治,充實醫療器械臨(lin) 床試驗檢查資源。臨(lin) 床試驗監管畢竟是新生事物,起步較晚,檢查資源相對不足。2019年5月,廣東(dong) 省藥監局在醫療器械臨(lin) 床試驗專(zhuan) 業(ye) 委員會(hui) 基礎上,組建評估專(zhuan) 家團隊,開創性地以政府購買(mai) 服務的方式委托開展省內(nei) 醫療器械臨(lin) 床試驗交叉檢查;2020年底,廣東(dong) 省藥監局組織開展省內(nei) 臨(lin) 床試驗機構監督抽查。評估專(zhuan) 家團隊作為(wei) 第三方專(zhuan) 業(ye) 檢查評估機構均為(wei) 各主要醫療機構的項目管理者,具備良好的專(zhuan) 業(ye) 素質,了解申報產(chan) 品的技術特點,熟悉項目質量控製的管理流程等。
加強醫療器械臨(lin) 床試驗監管建議
總結廣東(dong) 省醫療器械臨(lin) 床試驗管理經驗,建議各級監管部門細化職責分工、加強對臨(lin) 床試驗機構和項目的監督管理、完善檢查結果處理、推進監管能力建設,更好進行臨(lin) 床試驗監管。
經過幾年備案,各省份醫療器械臨(lin) 床試驗機構數量已趨於(yu) 平穩,藥品監管部門應該實現全覆蓋檢查。從(cong) 風險管控角度講,既往未獲得藥物臨(lin) 床試驗資質的臨(lin) 床試驗機構,其從(cong) 業(ye) 經驗相對欠缺、質量管控較難保障,監管部門迫切需要及時掌握其實際情況,迫切需要提高其法規意識。因此,對於(yu) 備案機構數量較多的省份,建議首先覆蓋檢查該類機構;對於(yu) 原已具備藥物臨(lin) 床試驗資質的機構,可以與(yu) 藥物臨(lin) 床試驗機構合並檢查,提高檢查效率。
醫療器械臨(lin) 床試驗項目不僅(jin) 數量多,而且持續新增,一個(ge) 項目從(cong) 備案到實施再到結題,往往要曆經數月甚至長達數年。建議以監督抽查的方式,按照每年隨機抽取不少於(yu) 20%比例對項目開展現場檢查,盡量涵蓋醫療器械和體(ti) 外診斷試劑兩(liang) 類產(chan) 品,優(you) 先選取在新機構開展的新項目;對於(yu) 注冊(ce) 審評審批、嚴(yan) 重不良事件及投訴舉(ju) 報信訪等涉及到的問題線索,開展有因飛行檢查。
發現臨(lin) 床試驗機構不具備《醫療器械臨(lin) 床試驗機構條件和備案管理辦法》規定的條件和要求的,應當責令其限期整改並在整改完成後提出複查申請,整改期內(nei) 不得承接新的醫療器械臨(lin) 床試驗項目,複查仍未通過的,取消其備案,並通報同級衛生健康主管部門;項目檢查時發現存在真實性問題的,監管部門應在詳盡調查事由、公正厘清責任並充分聽取申辯的基礎上,依據《行政許可法》《醫療器械監督管理條例》的規定對責任方作出嚴(yan) 肅處理。
此外,監管部門還應當建立適應本行政區域醫療器械產(chan) 業(ye) 發展實際的職業(ye) 化專(zhuan) 業(ye) 化醫療器械臨(lin) 床試驗檢查員隊伍,不斷加大法規業(ye) 務培訓,不斷提高檢查能力水平。建議以省為(wei) 單位成立行業(ye) 自律組織,加強法規宣貫培訓,引導強化行業(ye) 自律。
相關(guan) 鏈接:
廣東(dong) 省醫療器械臨(lin) 床試驗監管主要流程
一、現場檢查前準備
在正式實施現場檢查前的2周至4周內(nei) ,通過政務網站發布通告,明確檢查對象。提前準備檢查所需的現場檢查表格文書(shu) 及常用法規文件匯編。機構檢查的,應準備該機構在備案信息係統中的填報信息;項目檢查的,應準備該項目的臨(lin) 床試驗備案表。
印發工作通知,成立檢查小組、分配檢查任務,明確具體(ti) 檢查日期及聯係方式。協調聯係並書(shu) 麵要求有關(guan) 專(zhuan) 家,對於(yu) 機構檢查的,優(you) 選三級甲等公立醫院機構辦公室管理者;對於(yu) 項目檢查的,優(you) 選對口專(zhuan) 業(ye) /領域的副高以上職稱臨(lin) 床醫生/檢驗師/護師。
製作現場檢查通知書(shu) ,在現場檢查實施3天前,通知相應的臨(lin) 床試驗機構或/及申辦者,必要時抄送所在地省級藥品監督管理部門。
二、檢查組成員構成
每個(ge) 檢查小組由4-5人組成,其中組長1名、組員3~4名。組長負責與(yu) 被檢單位溝通聯係,確定具體(ti) 檢查行程安排。組長宜為(wei) 處級幹部,組員包括省藥監局醫療器械監管人員、申辦者所在地市級監管人員、技術審評/檢驗檢測人員,以及外邀臨(lin) 床專(zhuan) 家。
三、檢查時間安排
原則上對每家醫療器械臨(lin) 床試驗機構或每個(ge) 醫療器械臨(lin) 床試驗項目的檢查時間不超過2天,省內(nei) 檢查往返路程包含在內(nei) 。開展省外檢查的,一般在一周內(nei) 完成2個(ge) 被檢對象的現場檢查。
四、現場檢查環節
預備會(hui) 。現場檢查前一天,檢查組組長組織全體(ti) 檢查人員召開預備會(hui) ,熟悉檢查任務和檢查方案、研究確定檢查方法,落實相關(guan) 紀律要求。
首次會(hui) 議。檢查當天,檢查組向臨(lin) 床試驗機構出示檢查通知、通報檢查組人員組成、檢查事由、現場要求。申辦方人員同時到會(hui) 。
現場檢查。檢查人員調閱臨(lin) 床試驗機構保存的臨(lin) 床試驗方案、臨(lin) 床試驗報告、病例報告表以及其他原始試驗資料,全麵、真實、客觀地記錄現場檢查情況及存在問題。需要取證的,檢查組可采用不同的方式進行證據留存,如複印、錄音、攝像等。
綜合會(hui) 議。組長主持召開綜合會(hui) 議,檢查組成員匯報各自發現的問題,檢查組共同討論並確認,如實、清晰地撰寫(xie) 醫療器械臨(lin) 床試驗監督檢查意見表。
末次會(hui) 議。檢查組向臨(lin) 床試驗機構、申辦者通報檢查情況,臨(lin) 床試驗機構和申辦者作解釋說明,相關(guan) 文件簽字蓋章等。
五、現場檢查內(nei) 容
醫療器械項目按《國家藥監局綜合司關(guan) 於(yu) 印發醫療器械臨(lin) 床試驗檢查要點及判定原則的通知》中的檢查要點進行檢查;體(ti) 外診斷試劑項目按《體(ti) 外診斷試劑臨(lin) 床試驗技術指導原則》進行檢查;醫療器械臨(lin) 床試驗機構主要按《國家食品藥品監督管理總局 國家衛生和計劃生育委員會(hui) 關(guan) 於(yu) 發布醫療器械臨(lin) 床試驗機構條件和備案管理辦法的公告》進行檢查。
六、研定處理意見
臨(lin) 床試驗機構檢查。對檢查組返回的材料進行綜合研判,根據存在問題的嚴(yan) 重程度及風險等級擬定處理建議,必要時組織專(zhuan) 家進行論證。及時將處理意見書(shu) 麵反饋被檢查機構。
臨(lin) 床試驗項目檢查。對於(yu) 存在合規性問題的,書(shu) 麵反饋發現問題及處理意見,要求申辦者會(hui) 同臨(lin) 床試驗機構共同分析原因、製定預防糾正措施、提交整改報告。在審項目存在真實性問題的,依法作出不予注冊(ce) 行政許可決(jue) 定,1年內(nei) 不再受理相同項目的注冊(ce) 申請。
七、資料歸檔要求
收回整改報告,匯總形成階段性監督檢查報告。及時整理方案、通知、現場檢查記錄、專(zhuan) 家討論意見等完整材料後,編目存檔。按照機關(guan) 檔案管理辦法有關(guan) 規定保存10年。